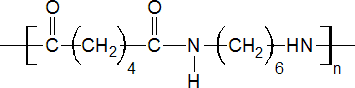
- nylon 4 - polímero formado por 2-pirrolidone [CH2CH2CH2C(O)NH]
- nylon 6 - generado a partir de la policondensación de la caprolactama [CH2(CH2)4NHCO]
- nylon 66 – fabricado por condensación de la hexametilenodiamina [H2N(CH2)6NH2] con ácido adípico [COOH(CH2)4COOH]
- nylon 69 - fabricado por condensación de la hexametilenodiamina [H2N(CH2)6NH2] con ácido azelaico [COOH(CH2)7COOH]
- nylon 610 - fabricado por condensación de la hexametilenodiamina con ácido sebácico [COOH(CH2)8COOH]
- nylon 6/12 - fabricado a partir de la hexametilenodiamina y el ácido dibásico
- nylon 11- producido por policondensación del ácido amino-undecanoico [NH2CH2(CH2)9COOH]
- nylon 12 - fabricado a partir de la polimerización de la laurolactama [CH2(CH2)10CO]
- ciclododecalactama, con unidades metilenos
Los nylons son unos de los polímeros más comunes usados como fibra. En
todo momento encontramos nylon en nuestra ropa, pero también en otros lugares,
en forma de termoplástico.

Los nylons también se llaman poliamidas, debido a los característicos
grupos amida en la cadena principal. Las proteínas, tales como la seda a la cual
el nylon reemplazó, también son poliamidas. Estos grupos amida son muy polares
y pueden unirse entre sí mediante enlaces por puente de hidrógeno. Debido a
ésto y a que la cadena de nylon es tan regular y simétrica, los nylons son a
menudo cristalinos, y forman excelentes fibras.

El nylon se llama
nylon 6.6, porque cada unidad repetitiva de la cadena polimérica, tiene dos
extensiones de átomos de carbono, cada una con una longitud de seis átomos de
carbono. Otros tipos de nylon pueden tener diversos números de átomos de
carbono en estas extensiones.
Los nylons se pueden sintetizar a partir de las diaminas y los cloruros de diácido. El nylon 6.6 se hace con los monómeros cloruro del adipoilo y hexametilén diamina
Los nylons se pueden sintetizar a partir de las diaminas y los cloruros de diácido. El nylon 6.6 se hace con los monómeros cloruro del adipoilo y hexametilén diamina

NYLON 6,6
El Nylon 6,6 es producto de la reacción de ácido adípico y
hexametilenediamina. La fabricación de los productos intermedios para las
poliamidas es sumamente importante, no sólo es la calidad del polímero, como
color, el grado de polimerización, y linealidad fuertemente dependiente de la
calidad del ingrediente, sino también el éxito económico del productor es a
menudo determinado por los rendimientos y el costo de fabricación de los
ingredientes.
Ácido adípico
Hexametilenediamina
 Nylon-6,6
Nylon-6,6
El ácido adípico tiene una amplia variedad de usos comerciales además de la
fabricación del nylon 6,6, y así es un químico industrial común. Muchos caminos
para su fabricación se han desarrollado durante los últimos años, pero la
mayoría de los procesos en uso comercial procede a través de una oxidación de
dos pasos del ciclohexano o uno de sus derivados. El ciclohexano normalmente se
oxida con aire a temperaturas elevadas en presencia de un catalizador
conveniente, se produce una mezcla de ciclohexanona y ciclohexanol en el primer
paso, ketona-alcohol normalmente abreviado KA o aceite de KA:
En el segundo paso, el KA es oxidado por ácido nítrico a ácido adípico que
está separado, normalmente purificado a través de la cristalización y
secado.
Virtualmente todas las hexametilenediaminas fabricadas se usan en la
producción de nylon-6,6, con una cantidad pequeña para producir diisocianatos
Éste se produce vía la reducción de adiponitrilo (ADN).
La reacción de reducción es exotérmica generalmente se lleva a cabo en un
proceso de alta o baja presión. En el proceso de presión alta, el catalizador es
cobalto o hierro se usa a 20-35 MPa (3000-5000 psi) y una temperatura de 100-150
’C. El proceso de baja presión usa un catalizador de níquel Raney que contiene
hierro o cromo activado por sodio o hidróxido de potasio en solución y opera a
una presión de 2-3.5 MPa (300-500 psi) y una temperatura de 60-100 ºC (Raney es
una marca de fábrica registrado de W. R. Grace Co.). Aunque la temperatura y
rangos de presión están sustancialmente reducidos en el proceso de baja presión
y así la inversión importante también es reducida, la productividad es más baja
y los costos del catalizador son más altos que para los procesos de presión
alta.
Existen tres caminos comerciales con ADN en uso. El primer método,
hidrocianacion directa de 1,3-butadieno, ha reemplazado un proceso más viejo,
cianacion vía la reacción de cianuro de sodio con 1,4-diclorobutano debido al
costo más bajo y menos productos desechados del nuevo proceso. Durante los pasos
iniciales del proceso de hidrocianacion directo; una mezcla de dos isómeros se
genera, pero el isómero echado se convierte prontamente a lineal
3-pentenonitrilo.
En el paso final, el dinitrilo se forma de la adicion antiMarcovnicov de
cianuro de hidrógeno a la presión atmosférica y 30-150 ºC en la fase líquida con
un catalizador de Ni(0). El derivado principal, 2-metilglutaronitrilo, cuando es
hidrogenado usando un proceso similar que para la conversión de ADN a
hexametilenediamina, produce 2-metil-1,5-pentanediamina o
2-metilpentametilene-diamina (MPMO) que también se usa en la fabricación de
poliamidas como un comonomero. En el segundo método para producir ADN, conocido
como electrohidrodimerizacion, dos moles de acrilonitrilo se combina e hidrogena
en una célula electroquímica donde las dos medio - celdas están separadas por
una membrana.
En el proceso de la segunda generación, la membrana no se necesita para
separar las dos reacciones en las medio - celdas; en cambio, una finamente
dividida emulsión de las dos fases que consiste en una fase orgánica que
contiene acrilonitrilo y ADN se suspende en la fase acuosa que contiene
Na2HPO4, una sal del tetraalkilamonio, y acrilonitrilo.
Los electrodos pueden ser grafito y magnetita o más recientemente, cadmio y
hierro. En el tercero, el ácido adípico se convierte a ADN vía la
dehidroaminacion con NH3 (gas) o en fase líquida; se usa un
catalizador para la deshidratación, normalmente ácido fosfórico.
Se usan tres procesos para producir nylon-6,6. Dos de éstos empiezan con la
sal de nylon 6,6, la combinación de ácido adípico y hexa metilenediamina en
agua, ellos son procesos batch o en autoclave o procesos de polimerización
continuos. El tercero, el proceso de polimerización de fase sólida, comienza con
pellets de bajo peso molecular normalmente hechos vía autoclave, y continúa
aumentando el peso molecular del polímero en un gas inerte calentado, a
temperatura tal que nunca alcance el punto de fusión del polímero.
La sal de nylon 6,6, adipato de hexametilenediamonio, es hecho agregando
ácido adípico a una solución de hexametilenediamina en agua. La diamina
normalmente se guarda a aproximadamente 85% de la concentración en agua para
guardarlo en el estado líquido para la facilidad de manejo y cubierto con un gas
inerte, N2, para prevenir la oxidación y la formación de color. La
diamina se diluye antes de la reacción para que la concentración final de sal
tenga casi 50 %. A esta solución, con un ligero exceso de diacido se agrega y
completamente se disuelve y neutraliza; entonces, en un segundo reactor, el
resto se agrega para alcanzar el deseado equilibrio estequiometrico. El punto
final es determinado con mucha precisión vía la medida del pH en una muestra
diluida. En el pasado la solución de sal se filtraba entonces; a través del
carbón de leña activado para quitar color e impurezas, pero en los años noventa
la calidad de los materiales de arranque y el grado de mando del proceso ha
eliminado la necesidad por este paso. Esta solución de sal se mantiene bajo gas
inerte hasta que se envíe al proceso de polimerización. La dilución de los
ingredientes y la reacción exotermica (110 kJ/mol (26.4 kcal/mol)) genera calor
que puede recuperarse y puede usarse en otros pasos en el proceso. Si la sal
seca será aislada de la solución, puede ser precipitado por la adicion de
metanol, lavado, filtrado, y secado, ya que su solubilidad en alcohol es baja
(0.4% a las 25’C). Un método alternativo se ha desarrollado para producir sal
seca en un proceso continuo usando una solución saturada de sal de nylon-6,6 de
la sal sólida puede ser precipitada ajustando la temperatura y concentración. El
ácido adípico esta disuelto en el reciclado, solución acuosa saturada de sal de
nylon a aproximadamente 60 ºC bajo nitrógeno. Cuando la diamina se agrega como
una solución acuosa al 85%, la sal adicional se forma la mayoría que precipita
fuera de la solución, y los aumentos de temperatura. La mezcla es enfriada y
precipita la máxima cantidad de sal. Esto es separado por centrifugacion; la sal
aislada se lava entonces y se seca. El licor madre se recalienta y recicla. La
sal seca es bastante estable; puede usarse para transportar ingredientes para
nylon-6,6 en distancias largas, y no exige una atmósfera inerte para prevenir
degradación. Sin embargo, nunca se usa internamente para la producción de
nylon-6, 6, porque el diacido-diamina puro o la solución de sal tienen un costo
industrial más bajo.
En el primer paso del proceso del autoclave, la solución de sal se concentra
a aproximadamente 75% normalmente hirviendo en un vaso llamado evaporador. El
calor contenido en el vapor generado en este paso puede recuperarse en un
intercambiador de calor y puede usarse en otra parte en el proceso. Después de
que la sal se concentra, se alimenta en un autoclave que son grandes y a veces
agitados bajo presión, donde la polimerización tiene lugar. A menudo los
aditivos, como TiO2, los estabilizadores, etc., se inyectan a estas
alturas en el proceso. Durante la polimerización, se ajustan la temperatura y
presión y controlan la pérdida de diamina y vapor. En el primer paso del ciclo
del autoclave el vaso está cerrado y la temperatura se aumenta, que permite
aumentar la presión a 1.75 MPa (250 psig). Durante este paso, la mayoría de la
diamina y el diacido reacciona para formar oligomeros. Después de que la masa
hirviente se sostiene a presión durante un tiempo suficiente para que la
reacción llegue al equilibrio, el vapor en exceso se extrae y la reacción de la
polimerización provoca un aumento de peso molecular. Como resultado del
equilibrio entre la diamina ligada y la no ligada, la diamina libre se pierde
con el vapor pero puede recuperarse y puede reciclarse. En el paso final, la
temperatura se eleva a 275ºC mientras la presión se sostiene a presión
atmosférica. La polimerización entonces se aproxima al equilibrio. Un vacío
adicional, es el paso de acabado y puede agregarse si todavía se desea un
polímero de peso molecular más alto; sin embargo, este paso del proceso puede
llevar a complicaciones como descoloracion, que es el resultado de la oxidación,
degradación térmica y la dificultad de agotar la masa del polímero del vaso que
tiene la viscosidad más alta. Después de que la polimerización se completa, el
polímero se extrae del autoclave a través de un dado que forma una serie de
cuerdas del polímero continuas. Éstos se alimentan en una máquina que modela y
refresca el polímero en agua, se corta en pellets cilíndricas pequeñas, y se
separan del agua. Los pellets están, entonces, secos y se guardan para un
proceso posterior o venta. Las ventajas del proceso del autoclave son inversión
relativamente baja, flexibilidad, y el funcionamiento relativamente simple. Las
desventajas son bajas producciones, costos de mano de obra altos, la variación
de propiedades del polímero a través del lote y del lote al lote, y las
dificultades para obtener el polímero de peso molecular alto.
El nylon 6 no se comporta de manera diferente al nylon 6.6. La única razón por
la que se fabrican los dos tipos, es porque DuPont patentó el nylon 6.6 y otras
compañías tuvieron que inventar el nylon 6 para poder entrar en el negocio del
nylon.

NYLON 6
El nylon 6 se obtiene a partir
de una sola clase de monómero, llamado caprolactama.

El nylon 6 se obtiene calentando caprolactama a
unos 250° C en presencia de aproximadamente 5-10% de agua. El oxígeno del
carbonilo toma uno de los átomos de hidrógeno del agua.

El oxígeno del carbonilo cede un par de
electrones al átomo de hidrógeno del agua, robándole ese hidrógeno al agua. Esto
nos conduce a un carbonilo protonado y a un grupo hidroxilo libre. Pero primero,
recordemos que ese oxígeno del carbonilo ahora tiene una carga positiva. Lo cual
desestabiliza al oxígeno, de modo que toma un par de electrones del doble enlace
del carbonilo, dejando la carga positiva sobre el átomo de carbono del
carbonilo.

Pero los carbocationes no son estables. El
carbocatión atrae a los nucleófilos con el fin de compensar la carga negativa.
Es entonces que, el ión hidróxido que se había formado cuando la caprolactama le
robó un protón a una molécula de agua, ataca al carbocatión.

La molécula que se forma ahora es un gem diol
inestable. Es decir que a continuación se produce un reordenamiento de
electrones. El átomo de nitrógeno dona un par de electrones a un átomo de
hidrógeno de uno de los grupos hidroxilo tomándolo para sí. Los electrones que
compartía el hidrógeno con su oxígeno, pasan a formar un doble enlace entre el
oxígeno y el átomo de carbono. Y por último, los electrones compartidos por el
carbono y el nitrógeno se mudan hacia el nitrógeno, rompiendo el enlace
carbono-nitrógeno.

El anillo se rompió y no hay más caprolactama!
Ahora nos quedamos con un aminoácido lineal. Ese aminoácido lineal puede
reaccionar con otra molécula de caprolactama, de forma muy parecida a como hizo
el agua. La molécula de caprolactama se apoderará del hidrógeno ácido del
aminoácido lineal. El oxígeno del carbonilo dona un par de electrones a ese
hidrógeno, separándolo del aminoácido.

Tal como se esperaba, los electrones se
reordenan para formar el carbocatión, igual que antes:

Este carbocatión es susceptible al ataque de un
nucleófilo. En este caso el aminoácido que acaba de perder su hidrógeno ácido
reacciona con el carbocatión.

Esto nos da un derivado de amonio y éste en
particular es sumamente inestable. Por lo tanto los electrones hacen su “juego”.
El nitrógeno del anillo toma un hidrógeno del nitrógeno del amonio. Además, el
enlace entre el carbono y el nitrógeno se rompe, abriendo el anillo.

Ese grupo carboxilato en el extremo de la
molécula va a robar el hidrógeno del alcohol.

Esto origina un nuevo grupo carbonilo en la
mitad de la molécula y regenera el ácido carboxílico. (Un pequeño secreto: nadie
sabe realmente el orden de los dos últimos pasos. Podrían ocurrir en sentido
inverso. Sólo sabemos que los dos ocurren antes de que termine todo.) Es una
polimerización por crecimiento de cadena. Ahora que tenemos otra vez el ácido,
es seguro que reaccionará con otra molécula de caprolactama, y luego con otra y
otra, hasta que obtengamos largas cadenas de nylon 6.

KEVLAR
La síntesis de este polimero se lleva a cabo en solución N-metil-pirrolidona y cloruro de calcio, a través de una polimerización por pasos a partir de la p-fenilendiamina y el dicloruro del ácido tereftálico o cloruro de tereftaloílo. La reacción se lleva a cabo a temperaturas bajas debido a su gran exotermicidad. Posteriormente el polímero se hace precipitar y se disuelve en ácido sulfúrico concentrado en el cual Kevlar (y otras poliarilamidas) forma una solución cristalina que se emplea para precipitar o coagular las fibras a la vez que se estiran mediante un sistema de hilado.
En otras variantes de síntesis de poli(aril)amidas, otros autores emplean otros disolventes como la dimetilacetamida (DMAc).
La poli(arilamida) así obtenida (se trata de una aramida) tiene un alto grado de orientación molecular a la vez que hay se dan un gran número de interacciones por puentes de hidrógeno entre los grupos amida. Por estas interacciones y este empaquetamiento, las fibras obtenidas presentan unas altas prestaciones.
VIDEOS

Buena informacion, aunque se apreciaria mas si contara con referencias.
ResponderEliminar